A. Tanggal Percobaan
25 Februari 2009
B. Tujuan Percobaan
1. Menentukan titk akhir titrasi asam kuat dan basa kuat
2. Menentukan konsentrasi larutan HCl
3. Menentukan kadar cuka perdagangan
C. Dasar Teori
1. Titrasi merupakan suatu metode untuk menentukan kadar suatu zat dengan menggunakan zat lain yang sudah diketahui konsentrasinya.
2. Titik akhir titrasi adalah keadaan dimana reaksi telah berjalan dengan sempurna yang biasanya ditandai dengan pengamatan visual melalui perubahan warna indikator.
D. Alat dan Bahan
Alat:
Pipet takar
Filler
Statif
Buret
Erlenmeyer
Bahan:
30 ml HCl
NaOH 0,2 M
Aquades
5 ml cuka
Indikator pp
E. Prosedur Kerja
Menentukan Titik Akhir Titrasi Asam Kuat dengan Basa Kuat
a. Mengambil 10 ml larutan HCl, memasukkannya ke dalam Erlenmeyer
b. Masukkan larutan NaOH 0,2 M ke dalam buret
c. Menambahkan 3 tetes indicator PP ke dalam larutan HCl
d. Menitrasikan larutan HCl dengan larutan NaOH 0,2 M sampai warna larutan menjadi merah muda
e. Mencatat volume larutanNaOH 0,2 M yang digunakan
f. Mengulangi percobaan seperti langkah-langkah sebelumnya
g. Menghitung volume rata-rata dari dua percobaan yang telah dilakukan
h. Menentukan titik akhir titrasinya
i. Menghitung konsentrasi larutan HCl yang digunakan
Menentukan Kadar Cuka Perdagangan
a. Mengambil 5 ml uka, mengencerkannya dengan akuades sampai 50 ml
b. Mengambil 10 ml larutan cuka yang telah diencerkan, masukkan ke dalam Erlenmeyer
c. Menambahkan 3 tetes indicator PP
d. Menitrasikan dengan larutan NaOH 0,2 M, sampai warna larutan menjadi merah muda
e. Mecatat volume laruta NaOH 0,2 M yang digunakan
f. Mengulangi percobaan di atas dengan langkah yang sama
g. Menghitung volume rata-rata dari dua percobaan yang telah dilakukan
h. Menghitung kadar cuka bila cuka murni mempunyai molaritas 17,4
F. Hasil Pengamatan
Data Titik Akhir Titrasi Asam Kuat dengan Asam Basa
Menentukan Kadar Cuka Perdagangan
G. Analisis Data dan Pembahasan
Menentukan Titik Akhir Titrasi Asam Kuat dengan Asam Basa
1) Titik akhir titrasi adalah suatu keadaan dimana larutan tersebut tepat terjadi perubahan warnanya
2) Titik ekivalen adalah titik dimana larutan tepat ber-pH 7 (hanya bisa dibuktikan secara teoritis)
3) Kesalahan Titrasi adalah selisih dari titik akhir titrasi dengan equivalen
4) Konsentrasi HCl adalah 0,1 M
Menentukan Kadar Cuka Perdagangan
1) Konsentrasi larutan cuka [CH3COOH] yang digunakan adalah [0,04]
2) Kadar larutan cuka 0,04 x 100% = 0,23%
17,4
Pertanyaan
1. Apa fungsi indicator pada percobaan di atas?
2. Tuliskan persamaan reaksi setara antara
a. Larutan cuka dengan NaOH
b. Cuka dengan larutan NaOH
3. Berapa pH campuran ketika 10 ml larutan HCl ditirasi dengan
a. 2 ml larutan NaOH 0,2 M
b. 5 ml larutan NaOH 0,2 M
c. 7 ml larutan NaOH 0,2 M
Jawaban
1. Untuk menentukan kapan suatu larutan ber-pH netral
2. persamaan
3. pH campuran
H. Kesimpulan
Titik akhir titrasi asam kuat dan basa kuat diperoleh ketika keduanya dititrasikan dengan komposisi yang sama, dengan kata lain jumlah molnya sama. Titrasi merupakan salah satu metode yang digunakan untuk menentukan konsentrasi suatu larutan yang belum diketahui, dengan menggunakan perbandingan V1.M1 = V2.M2. Menentukan kadar cuka dapat diperoleh dengan menggunakan titrasi. Setelah diketahui molaritasnya maka kadar dapat dicari dari perbandingan molaritas awal dibanding molaritas akhir dalam satuan persen.
Selasa, 03 Maret 2009
Kimia - Titrasi Asam Basa
Posted by luv is ol at 16.08
Langganan:
Posting Komentar (Atom)


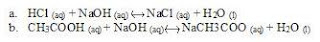

0 comments:
Posting Komentar