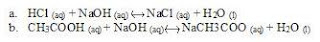HUKUM UTAMA ARCHIMEDES
A. Dasar Teori
a. Gaya ke atas
Benda yang diangkat ke dalam air akan terasa lebih ringan jika dibandingkan dengan kita mengangkatnya di udara. Hal itu dikarenakan air memberikan gaya ke atas pada benda
Hukum Archimedes : sebuah benda yang tercelup di dalam fluida akan menerima gaya ke atas sebesar berat fluida yang dipindahkan
FA = Pr.V.g
b. Mengapung, Melayang dan Tenggelam
Mengapung : PB < pb =" Pf"> Pf
c. Penerapan Hukum Archimedes
Penerapan hukum archimedes sering kita jumpai dalam kehidupan sehari-hari, contohnya pada kapal laut, kapal selam, galangan kapal, balon udara dan hidrometer.
B. Tujuan
Menentukan hubungan antara gaya ke atas oleh zat cair dengan berat zat cair yang dipindahkan
C. Alat dan Bahan
• Gelas Berpancuran
• Gelas ukur
• Neraca pegas
• Beban
• Air
D. Set Up Percobaan
E. Cara Kerja
1. Mengisi gelas berpancuran dengan air hingga penuh
2. Menimbang berat badan di udara (w) dengan neraca pegas
3. Menyelupkan beban yang tergantung pada neraca pegas ke dalam gelas berpancuran yang telah berisi air penuh
4. Menampung semua air yang keluar dari pancuran ke dalam gelas ukur
5. Membaca penunjukan skala neraca pegas (w') dan mencatatnya
6. Membaca penunjukan skala yang ditunjukkan oleh gelas ukur (Vf) dan mencatatnya
7. Mengulangi langkah 1 s/d 6 untuk beban lain sebanyak 5 kali
F. Hasil Pengamatan
G. Analisa Data
Gaya apung adalah gaya berarah ke atas yang dikerjakan fluida pada benda yang tercelup pada fluida. Bergantung pada kerapatan fluida x volume benda, tapi tidak pada komposisi atau bentuk benda x besarnya sama dengan berat fluida yang dipindahkan oleh benda.
Suatu benda yang dicelupkan sebagaian atau seluruhnya pada suatu fluida, benda itu akan mendapat gaya ke atas yang besarnya sama dengan berat fluida yang dipindahkan oleh benda tersebut
Fa didapat dari wbu – wbf
Gaya apung terjadi karena tekanan dalam sebuah fluida sebanding dengan kedalamannya. (tekanan di bagian bawah benda lebih besar daripada tekanan di bagian atasnya)
H. Pertanyaan dan Jawaban
1. Berapa berat benda zat cair yang dipindahkan dengan menggunakan persaman berat benda di udara dikurangi berat benda dalam fluida?
a. FA = w – w' = 1 - 0,9 = 0,1
b. FA = w – w' = 2,9 - 2,4 = 0,5
c. FA = w – w' = 1 - 0,9 = 0,1
d. FA = w – w' = 2 - 1,7 = 0,3
e. FA = w – w' = 4,9 - 4,2 = 0,7
2. Bandingkan hasil perhitungan pertanyaan no 1 dengan berat zat cair dari hasil percobaan!
• Hasilnya relatif sama antara berat benda zat cair yang dipindahkan dengan menggunakan persaman dengan berat zat cair dari hasil percobaan
3. Apa saja faktor yang mempengaruhi besar gaya apung pada suatu benda pada fluida?
• Massa jenis fluida
• Volume fluida yang dipindahkan
• Percepatan Gravitasi
• Berat benda di udara dan di dalam fluida
4. Bagaimana persamaan Gaya apung yang dialami oleh benda?
• FA = Pr.V.g
5. Apabila p fluida dan benda berbeda, bagaimanakah keadaan posisi benda dalam fluida?
• P benda > P fluida → resultan gaya berarah ke bawah dan benda tenggelam
• P benda < P fluida → resultan gaya berarah ke atas dan benda terapung
I. Kesimpulan
• Besar gaya apung suatu benda dipengaruhi oleh massa jenis fluida, volume fluida yang dipindahkan gravitasi, gaya berat
• Besar gaya apung yang bekerja pada suatu benda yang dicelupkan sebagian atau seluruhnya ke dalam suatu fluida sama dengan berat fluida yang dipindahkan oleh benda tersebut
• Benda di dalam fluida lebih ringan dibandingkan berat benda di udara karena benda di dalam fluida mendapat gaya ke atas (gaya apung) sehingga benda kehilangan sebagian beratnya
Kamis, 12 Maret 2009
fisika - hukum utama archimedes
Posted by luv is ol at 10.26 0 comments
Selasa, 10 Maret 2009
Kimia - Larutan Penyangga
LAPORAN KEGIATAN
A. Judul Percobaan
Larutan Penyangga
B. Tanggal Percobaan
6 Maret 2009
C. Tujuan Percobaan
Mengetahui perbedaan perubahan pH larutan penyangga dan bukan larutan penyangga pada penambahan sedikit asam, basa, atau pengenceran.
D. Dasar Teori
Pada dasarnya larutan penyangga terjadi karena campuran asam lemah dan basa konjugasinya (dalam garam) atau campuran basa lemah dengan asam konjugasinya (dalam garam)
E. Alat dan Bahan
3 gelas kimia
Pipet
NaCl 0,1 M
HCL 0,1 M
NaOH 0,1 M
CH3COOHNa
CH3COOH
NH3 0,1 M
NH4Cl 0,1 M
Air akuades
Kertas lakmus
F. Prosedur Kerja
1. Menyiapkan 3 gelas kimia, mengisi masing-masing gelas dengan 10 ml larutan NaCl 0,1 M. Mengukur pH larutan dengan menggunakan indikator universal, kemudian:
· Menambahkan 1 ml HCL 0,1 M ke dalam gelas kimia I, mengukur pH larutan
· Menambahkan 1 ml NaOH 0,1 M ke dalam gelas kimia II, mengukur pH larutan
· Menambahkan 10 ml larutan akuades ke dalam gelas kimia III, mengukur pH larutan
2. Mencampurkan 25 ml larutan CH3COOH 0,1 M dan 25 ml larutan CH3COOHNa 0,1 M. Mengukur pH larutan dengan menggunakan indikator universal.
3. Menyiapkan 3 gelas kimia, mengisi masing-masing dengan 10 ml campuran larutan yang telah dibuat di no.2
· Menambahkan 5 tetes CH3COOH 0,1 M ke dalam gelas kimia I, mengukur pH larutan
· Menambahkan 5tetes NaOH 0,1 M ke dalam gelas kimia II, mengukur pH larutan
· Menambahkan 10 ml larutan akuades ke dalam gelas kimia III, mengukur pH larutan
4. Mencampurkan 25 ml larutan NH3 0,1 M dan 25 ml larutan NH4Cl 0,1 M. Mengukur pH larutan dengan menggunakan indicator universal
5. Menyiapkan 3 gelas kimia, mengisi masing-masing dengan 10 ml campuran larutan yang telah dibuat di prosedur kerja no.4
· Menambahkan 5 tetes HCl 0,1 M ke dalam gelas kimia I, mengukur pH larutan
· Menambahkan 5tetes NH4OH 0,1 M ke dalam gelas kimia II, mengukur pH larutan
· Menambahkan 10 ml larutan akuades ke dalam gelas kimia III, mengukur pH larutan
G. Hasil Pengamatan
H. Analisis data dan pembahasan
1. Larutan yang termasuk larutan penyangga adalah larutan CH3COOH + CH3COOHNa dan larutan NH3 + NH4Cl. Sedangkan larutan yang tidak ternasuk larutan penyangga adalah larutan NaCl
2. pH larutan penyangga jika ditambahkan sedikit asam, basa atau diencerkan akan tetap, sedangkan pada larutan bukan penyangga perubahan pH yang besar akan terlihat antara sesudah dan sebelum kita menambahkan sedikit asam, basa atau diencerkan
I. Kesimpulan
1. Larutan yang termasuk larutan penyangga adalah larutan CH3COOH + CH3COOHNa dan larutan NH3 + NH4Cl.
2. Larutan yang tidak ternasuk larutan penyangga adalah larutan NaCl
3. pH larutan penyangga akan tetap jika ditambahkan sedikit asam, basa atau diencerkan
4. pH larutan bukan penyangga akan mengalami perubahan yang cukup besar jika ditambahkan sedikit asam, basa atau diencerkan
J. Jawaban Pertanyaan
1. Larutan Penyangga adalah larutan yang dapat mempertahankan nilai pH apabila larutan tersebut ditambahkan sejumlah asam atau basa maupun diencerkan dengan menambah sejumlah volume air
2. sifat larutan penyangga adalah dapat mempertahankan nilai pH larutan walaupun ditambahkan sedikit asam, basa atau diencerkan.
3. Pada larutan penyangga perubahan pH sangat kecil jika ditambahkan dengan sedikit asam, basa atau air sehingga pH akan dianggap tetap. Pada larutan bukan penyangga perubahan pH yang besar akan terlihat jika kita menambahkan sedikit asam, basa atau air.
4. pH larutan penyangga dapat bertahan (tetap) jika ditambahkan sedikit asam, basa atau air. Sedangkan pH larutan yang bukan penyangga tidak dapat bertahan (berubah) jika ditambahkan sedikit asam, basa atau air.
5. pada penambahan sedikit asam atau basa pada larutan penyangga menyebabkan kesetimbangan akan bergeser ke kiri atau ke kanan, yang mengakibatkan berkurangnya ion tertentu, namun kekurangan tersebut dapat digantikan oleh ion yang sama yang berasal dari garam
Daftar Pustaka
Trisilo, Joko. 2009. KIMIA. Solo : CV.HaKa MJ
Posted by luv is ol at 15.02 0 comments
Selasa, 03 Maret 2009
Kimia - Titrasi Asam Basa
A. Tanggal Percobaan
25 Februari 2009
B. Tujuan Percobaan
1. Menentukan titk akhir titrasi asam kuat dan basa kuat
2. Menentukan konsentrasi larutan HCl
3. Menentukan kadar cuka perdagangan
C. Dasar Teori
1. Titrasi merupakan suatu metode untuk menentukan kadar suatu zat dengan menggunakan zat lain yang sudah diketahui konsentrasinya.
2. Titik akhir titrasi adalah keadaan dimana reaksi telah berjalan dengan sempurna yang biasanya ditandai dengan pengamatan visual melalui perubahan warna indikator.
D. Alat dan Bahan
Alat:
Pipet takar
Filler
Statif
Buret
Erlenmeyer
Bahan:
30 ml HCl
NaOH 0,2 M
Aquades
5 ml cuka
Indikator pp
E. Prosedur Kerja
Menentukan Titik Akhir Titrasi Asam Kuat dengan Basa Kuat
a. Mengambil 10 ml larutan HCl, memasukkannya ke dalam Erlenmeyer
b. Masukkan larutan NaOH 0,2 M ke dalam buret
c. Menambahkan 3 tetes indicator PP ke dalam larutan HCl
d. Menitrasikan larutan HCl dengan larutan NaOH 0,2 M sampai warna larutan menjadi merah muda
e. Mencatat volume larutanNaOH 0,2 M yang digunakan
f. Mengulangi percobaan seperti langkah-langkah sebelumnya
g. Menghitung volume rata-rata dari dua percobaan yang telah dilakukan
h. Menentukan titik akhir titrasinya
i. Menghitung konsentrasi larutan HCl yang digunakan
Menentukan Kadar Cuka Perdagangan
a. Mengambil 5 ml uka, mengencerkannya dengan akuades sampai 50 ml
b. Mengambil 10 ml larutan cuka yang telah diencerkan, masukkan ke dalam Erlenmeyer
c. Menambahkan 3 tetes indicator PP
d. Menitrasikan dengan larutan NaOH 0,2 M, sampai warna larutan menjadi merah muda
e. Mecatat volume laruta NaOH 0,2 M yang digunakan
f. Mengulangi percobaan di atas dengan langkah yang sama
g. Menghitung volume rata-rata dari dua percobaan yang telah dilakukan
h. Menghitung kadar cuka bila cuka murni mempunyai molaritas 17,4
F. Hasil Pengamatan
Data Titik Akhir Titrasi Asam Kuat dengan Asam Basa
Menentukan Kadar Cuka Perdagangan
G. Analisis Data dan Pembahasan
Menentukan Titik Akhir Titrasi Asam Kuat dengan Asam Basa
1) Titik akhir titrasi adalah suatu keadaan dimana larutan tersebut tepat terjadi perubahan warnanya
2) Titik ekivalen adalah titik dimana larutan tepat ber-pH 7 (hanya bisa dibuktikan secara teoritis)
3) Kesalahan Titrasi adalah selisih dari titik akhir titrasi dengan equivalen
4) Konsentrasi HCl adalah 0,1 M
Menentukan Kadar Cuka Perdagangan
1) Konsentrasi larutan cuka [CH3COOH] yang digunakan adalah [0,04]
2) Kadar larutan cuka 0,04 x 100% = 0,23%
17,4
Pertanyaan
1. Apa fungsi indicator pada percobaan di atas?
2. Tuliskan persamaan reaksi setara antara
a. Larutan cuka dengan NaOH
b. Cuka dengan larutan NaOH
3. Berapa pH campuran ketika 10 ml larutan HCl ditirasi dengan
a. 2 ml larutan NaOH 0,2 M
b. 5 ml larutan NaOH 0,2 M
c. 7 ml larutan NaOH 0,2 M
Jawaban
1. Untuk menentukan kapan suatu larutan ber-pH netral
2. persamaan
3. pH campuran
H. Kesimpulan
Titik akhir titrasi asam kuat dan basa kuat diperoleh ketika keduanya dititrasikan dengan komposisi yang sama, dengan kata lain jumlah molnya sama. Titrasi merupakan salah satu metode yang digunakan untuk menentukan konsentrasi suatu larutan yang belum diketahui, dengan menggunakan perbandingan V1.M1 = V2.M2. Menentukan kadar cuka dapat diperoleh dengan menggunakan titrasi. Setelah diketahui molaritasnya maka kadar dapat dicari dari perbandingan molaritas awal dibanding molaritas akhir dalam satuan persen.
Posted by luv is ol at 16.08 0 comments
Senin, 02 Maret 2009
Biologi - gangguan hati
1. Bibliografi
ditulis oleh ranywaisya pada 22 Oktober 2008
2. Tujuan penulisan artikel
Agar pebaca mendapat pengetahuan tentang cara mendeteksi gangguan hati lewat warna urin
3. Fakta unik dari artikel
Gejala gangguan hati dapat dilihat dari bilirubin yang berlebihan di dalam kulit dan air kemih yang menyebabkan warna air kemih lebih gelap. Selain itu, perubahan dapat dilihat dari warna tinja
4. Pertanyaan yang muncul
· Gangguan yang berasal dari luar hati seperti batu di saluran empedu, penyempitan saluran empedu, kanker saluran empedu disebabkan oleh apa
· Arti dari bilirubin
· Arti dari penyakit hati alkoholik
· Maksudnya perubahan hormon selam kehamilan
· Arti fenobarbital, kolestiramin, ursodioxy cholic acid (UDCA)
5. Konsep penting yang berkaitan dengan biologi
· Kolestasis menyebabkan adanya penumpukan asam empedu, bilurubin dan kolesterol hati
· Berkurangnya empedu dalam usus, menyebabkan berkurangnya penyerapan kalsium dan vitamin D, akibat lebih lanjutnya adalah pengeroposan tulang sehingga merasa nyeri di tulang atau bahkan patah tulang
· Gangguan penyerapan bahan-bahan yang diperlukan untuk pembekuan darah menyebabkan mudahnya terjadi pendarahan
6. Refleksi
· Warna urin dapat menjadi tanda adanya gangguan di hati, karena itulah kita harus selalu memperhatikan adanya keanehan-keanehan yang terjadi pada tubuh kita, sebelum bertambah parah, maka kita harus mengetahuinya sejak dini
Posted by luv is ol at 17.33 0 comments
Biologi - diskusi tentang urin
Bahan Diskusi
1. Bagaimana susunan urin orang yang tidak sehat?
2. Mengapa urin orang tidak sehat mengandung protein dan glukosa
3. Apa yang membedakan susunan urin orang yang sehat dan penderita kencing manis?
4. Jelaskan proses pembentukan urin!
5. Apa perbedaan susunan urin primer dan urin sekunder?
6. Kelainan atau penyakit apa sajakan yang dapat diketahui dari hasil pemeriksaan urin?
7. Bagaimanakah akibatnya jika seseorang dalam darahnya mengandung glukosa dalam jumlah yang tinggi?
Hasil Diskusi
1. susunan urin orang yang sehat
· Air 95 %
· Na 0,35 %
· Cl 0,7 %
· K 0,15 %
· PO4 0, 15 %
· SO4 0,18 %
· NH4 0.4 %
· Asam urat 0,05 %
· Urea 2 %
· Kipatinin 0,075 %
2. karena pada orang yang sehat protein dan glukosa telah diserap kembali ke dalam tubuh dalam proses rearbsorbsi
3. pada penderita kencing manis ditemukan glukosa pada urinnya (glukosuria), sedangkan pada orang sehat urinnya tidak mengandung glukosa (glukosaria)
4. proses pembentukan urin
· Filtrasi : terjadi di kapsul bowman dan glomerolus, hasil dari filtrasi ini disebut urin primer. Susunan urin primer adalah air, glukosa, asam amino, ura dan ion-ion organic
· Rearbsorbsi : penyerapan kembali air, glukosa, asam amino, urea, ion-ion Na+, K+, Ca2+, Cl-, HCO3-, HbO42- di dalam tubulus kontortus proximal menghasilkan urin sekunder dengan komposisi air, garam, urea, pigmen empedu
· Augmentasi : pada tubulus kontortus distal terjadi penyerapan Na+, CL- ,urea dan terjadi sekresi H+ dan K+, dari tubulus-tububulus ginjal, urin sesungguhnya ini akan menuju rongga ginjal, selanjutnya menuju kantong kemih melalui saluran ginjal
5. urin primer : masih terdapat glukosa
urin sekunder : tidak terdapat glukosa
6. diabetes, hematuria, glikosuria, albuminoria
7. mengakibatkan diabetes sehingga jika terluka sulit tertutup
Posted by luv is ol at 16.29 0 comments
Rabu, 25 Februari 2009
Biologi - Susunan Urin
A. Tujuan
Untuk menguji kandungan zat dalam urin
B. Data
1. Pada uji pH setelah urin A dan B diberi Lakmus dapat diketahui Urin A dan B memiliki pH 6
2. Pada uji kandungan klor, terdapat endapan berwarna putih pada tabung Urin A dan B setelah diberi AgNO3 1%
3. Pada uji glukosa setelah diberi Fehling A + B 20 tetes kemudian dipanaskan warna urin A berubah dari warna kuning menjadi warna biru, sedangkan warna urin B berubah dari warna kuning menjadi warna hijau
4. Pada uji protein menggunakan Milon 20 tetes mengakibatkan munculnya endapan putih pada urin A dan terdapat gumpalan-gumpalan berwarna putih pada urin B
D. Pembahasan
1. melalui uji protein dapat diketahui bahwa urin B positif mengandung protein, hal ini dibuktikan dengan munculnya gumpalan putih. Sedangkan pada urin A tidak mengandung protein, hal ini dibuktikan tidak adanya gumpalan putih
2. melalui uji glukosa dapat diketahui bahwa urin B memiliki sedikit glukosa, hal ini dibuktikan dengan berubahnya warna kuning menjadi warna hijau pada urin B. sedangkan urin A tidak mengandung glukosa, hal ini dibuktikan dengan berubahnya warna kuning menjadi biru pada urin A
3. dapat diketahui bahwa urin B adalah urin orang yang tidak sehat sedangkan urin A adalah urin orang yang sehat
4. pada uji pH dan uji kandungan klor hasil uji urin A dan urin B sama, hal ini membuktikan urin orang yang sehat dan urin orang tidak sehat sama-sama menghasilkan urin yang mengandung klor dan tergolong asam lemah
E. Kesimpulan
1. Urin orang yang sehat tidak mengandung protein dan glukosa
2. Urin orang yang tidak sehat mengandung protein dan glukosa
3. Urin orang yang sehat dan tidak sehat memiliki kandungan klor dan tergolong asam lemah
Posted by luv is ol at 07.22 1 comments